Beitragsbild: Ende März 2018 in Stein-Wingert, fotografiert von Manfred Fetthauer
Die EU und der Chinesische Kormoran P.C. sinensis; von besonders schutzwürdig zu einer invasiven, gebietsfremden Tierart die der Union sorgen bereitet.
Niemandem der nur etwas Interesse an Natur hat oder funktionierende Sinne wie Sehen, Riechen und Hören besitzt, kann die offensichtlich Zunahme eines Bewohner von Europas Küsten, Seen und Wasserläufen entgangen sein. Von Cabo de Sao Vicente im Südwesten und Lesbos im Südosten bis zum Bottnischen Meerbusen im Norden ist der Chinesische Kormoran Phalacrocorax carbo sinensis (sinensis) immer häufiger gesehen und ist in vielen Gebieten bereits der dominierende Wasservogel. Von wenigen tausend Individuen in 1979 ist die Anzahl mittlerweile heute auf mehrere Millionen Tiere angewachsen.
Wenn es nach den Vogelschutzorganisationen und Behörden geht, ist dies ein beachtlicher Erfolg des Europäischen Vogelschutz und der EU Vogelschutz Richtlinie (79/409/EEC) das sinensis „wieder zurück gekehrt ist nach einer langer Zeit der Verfolgung“.
Wie viele andere die nicht umhin kamen die verheerenden Auswirkungen von sinensis auf die lokale Fischfauna, die abgestorbenen Bäume auf den übel riechenden Nistplätzen und den Ruheplätzen, war ich doch sehr erstaunt über dieses „Rückkehr“ da es überhaupt keine Aufzeichnungen über frühere Nistplätze. In meinem Heimtagebiet, dem Stockholmer Schärengarten, wurden die ersten Nistplätze 1994 dokumentiert. Heute gibt es ungefähr 20 Kolonien mit ungefähr 50.000 Individuen. Erst im August 2002 fiel mir auf „das die eigentlich noch nie hier gewesen waren!“ Dies war der Anfang meiner Versuche, dieses Durcheinander von widersprüchlichen Informationen und Aussagen, die die extrem verwirrenden und aufgeheizten Kormoran Diskussionen in Europa seit ca. 400 Jahren begleiten, zu beseitigen.
In 2008 schrieb ich das Essay „Der Chinesische Kormoran Phalacrocorax carbo sinensis (Blumenbach 1798) ein nicht heimischer Vogel“, in dem ich die Informationen die ich gesammelt hatte zusammen mit einer Übersicht der geschichtlichen Entwicklung und einige Vorschläge für Maßnahmen.
Ich hatte gehofft, dass dieser Bericht mehr Leute motivieren würde sich über die europäische Geschichte von sinensis im Klaren zu werden. Auf mein Essay wurde zuerst mit „ohrenbetäubender Stille“, gefolgt von einer Reihe von kritischen Artikeln von aufgeheizten Vogelschutzaktivisten in Vogel Magazinen und Zeitschriften, reagiert. Beispiele waren, Engström/Wirdheim, Vår Fågelvärld, 2009; Kinzelbach, Der Falke Sonderheft, 2010; Bieke, Die Vogelwelt, 2012; Bieke, Herrmann, Kinzelbach & de Rijk, Die Vogelwelt, 2013; Bieke, Ornis Fennica, 2014; Blomqvist, Österbottens Tidning, 2016; and Philström/Fritzén, OA-Natur, 2017
Zweifellos kann und wird diese Liste noch länger werden. Ich wurde entweder direkt mit Namen erwähnt oder nur indirekt durch meine Schlussfolgerung „dass der Kormoran eine aus China eingeschleppte invasive Art und als solche zu bekämpfen sei” (Beike et al., 2013), welche in Verbindung mit dem Schaden an der Fisch Fauna das Kernthema der Europäischen Kormoran Debatte ist. Nachdem ich die Artikel sorgfältig gelesen und die Referenzen geprüft hatte kommentiere ich diese auf verschiedenste Arten.
Meine Meinung ist und bleibt die das sinensis ein in Europa nicht heimischer Vogel ist. Genauso wenig ergaben meine weiteren Studien irgendeinen wissenschaftlichen Beweis, für vor-mittelalterlichen Brutnachweise von sinensis in Europa.
Es ist durchaus sinnvoll einige der Aussagen in den Artikeln zu kommentieren. Alle Aussagen haben die Unfähigkeit gemeinsam das sie nicht zwischen sinensis und dem natürlich vorkommenden Europäischen Großen Kormoran Phalacrocorax carbo carbo (carbo) unterscheiden. Zum Beispiel wird behauptet, dass subfossile Funde von P.carbo und ältere Informationen von „Vögel die in Kolonien in Bäumen brüten“ und „mehr als 100km von der Küste entfernt brüten“ sinensis sein müssten, da ja der Europäische große Kormoran (carbo) ein „Seevogel der an den Steilküsten an der Küste brütet“, wäre.
Das ist schlichtweg unwissenschaftlicher Unfug! Carbo ist kein „Meeresvogel“ und er zieht es vor, genau wie sinensis, in Bäumen zu nisten benötigt aber vor allem andern Gewässer die reich an Fischen sind und zwar unabhängig vom Salzgehalt des Gewässers.
Nach der letzten Eiszeit war carbo über große Teile Europas verbreitet, brütet aber heute hauptsächlich an unzugänglichen Küstenabschnitten von Frankreich, Großbritanien und Island. Mit ein Hauptgrund dafür war, das die Jungvögel schon seit der Steinzeit, ein wichtiger Bestandteil als Nahrungsquelle für den Menschen waren und deshalb auch eine der häufigsten gefundenen Vogelarten bei Archäologischen Ausgrabungen waren.
Unabhängig davon wo aus in Europa man sich das historische Vorkommen von sinensis anschaut endet die Spur im mittelalterlichen Holland. Zeitgleich mit dem Beginn des „Goldenen Zeitalters“ und dem sich rapide ausdehnenden Welthandel mit exotischen Pflanzen und Tieren.
Schon als im frühen 1600 Jahrhundert sich die ersten frei lebenden sinensis Kolonien in den Gewässern bei Rotterdam etablierten, beobachten die lokalen Fischer schnell die negativen Auswirkungen und leiteten Gegenmaßnahmen ein, unter dem Protest der Vogelschutz Aktivisten zu dieser Zeit. Seit dem frühen 1600 Jahrhundert bis Mitte des 1700 Jahrhunderts gibt es lediglich Aufzeichnungen von frei lebenden Kolonien in Holland und angrenzenden Ländern. Die erste größere Ausbreitungswelle erfolgt in den frühen 1800 über Deutschland und Dänemark nach Scania und Blekinge im südlichen Schweden.
Die meisten dieser Kolonien wurden dann so gründlich ausgerottet, so dass die Verbreitung in den 1900ern nur noch auf Holland und ein paar Vorkommen in Deutschland und Polen reduziert war und von den frühen 1970ern an wurde sinensis zugleich als „verfolgt und bedroht“ eingestuft.
Einige der führenden Ornithologen, der frühen 1990er Jahre, waren durch das plötzliche Erscheinen von einer erheblich kleineren Art des Kormoran als der wohlbekannte Europäische Große Kormoran (carbo), irritiert. Für J.A. and J.F. Naumann (1842) was es ein „Mysterium“; und auch C.L. Brehm (1824) konnte ebenfalls die Taxonomie nicht vollständig klären und ordnete die Art aber als Carbo nahe, ein und gab ihr den Unterart Beinamen „subcormoranus“.
Ein ähnlicher Ansatz wurde von S. Nilsson (1835) verfolgt, der ihm den Beinamen “medius” gab. Fast ein Jahrhundert später führten andere führende Ornithologen, wie z.b. E. Lönnberg (1915) and E. Hartert (1916), weiterführende taxonomische Untersuchungen zu den Unterschieden zwischen carbo und sinensis (subcormoranus/medius) durch und stellten fest das die Unterschiede signifikant waren aber dem damaligen Zeitgeist entsprechend, ordneten sie sinensis einer Unterart des Großen Kormoran (P.carbo) zu.
Die Taxonomie und Nomenklatur von sinensis bedarf einer gründlichen Überarbeitung und carbo und sinensis werden mit hoher Wahrscheinlichkeit, wie S. Nilsson (1858) schrieb, “beweisen das es 2 verschiedene Arten“ sind; eine Meinung die viele andere wie z.b. Alström (1985) und Kinzelbach (2010) auch vertreten.
Obwohl man sagen muss, dass der Unterart Beinamen sinensis gut gewählt scheint, da die ersten wissenschaftlichen Beschreibungen von Mlikovsky (2011) Staunton (1796) zugeschrieben und der Typen Fundort im November 1793 für “Pelecanus sinensis dem Weishan See in der Provinz Shandong in China (c.35°00’N, 116°50’E) werden.
Selbstverständlich ist der wissenschaftliche Name oder der Typen Fundort kein Beweis dafür das sinensis aus China stammt, aber die korrekt Bezeichnung sollte in der Tat entsprechend der volkstümlichen Bezeichnung, Chinesischer Kormoran lauten.
Die ersten Berichte über sinensis in Europa fallen zufällig mit dem am Anfang des 1600 Jahrhunderts schnell florierenden und genauso schnell wieder vergehendem Interesse am Fischen mit abgerichteten Kormoranen am englischen und Französischen Hof zusammen.
Die Holländer waren lange Europas führende Falkner und lieferten gegen enorme Summen, ausgebildete Jagdvögel unterschiedlicher Arten an die Aristokratie.
Die Chinesische Methode der Kormoranfischerei, war im gebildeten Europa, schon lange wohl bekannt. Der Vater der Europäischen Ornithologie, „Der Universalgelehrte” Conrad Gesner, schrieb in der „Historia Animalium Aves” (1555) des französischen Mönchs Odoric von Pordenone, das dieser während seiner Reise nach China im 1300 Jahrhundert mit eigenen Augen die Kormoranfischerei mit trainierten Kormoranen gesehen hatte.
Für viele hundert Jahre war dieses Buch ein ornithologisches Standardwerk und wurde von vielen anderen Autoren zitiert oder kopiert. Sogar Linnaies, wie viele andere auch, beschreibt diese Methode in “De usu avium” (1765), und sorgte damit für weitere aufregende Kapitel bei den geschichtlichen Erzählungen über sinensis.
Das die Vogelschutz Aktivisten, geblendet durch ihre Liebe zu den Vögeln, von je her immer sinensis fanatisch gegen Angler und anderen Betroffenen verteidigt haben ist nicht gut, aber letztendlich, auch nicht überraschend. Schlecht ist allerdings, das BirdLife Europe und seine Organisationen mit vielen kompetenten Ornithologen, aktiv, sinensis geschützt haben ohne überhaupt über dessen Europäische Geschichte nachzudenken.
Am allerschlimmsten ist aber, wie schlecht die Europäische Kommission und die nationalen Naturschutz Organisationen, mit dem Problem umgehen. Letztendlich sind sie ja verantwortlich für den durch sinensis angerichteten und aufgelaufenen Schaden von mehreren Milliarden Euro; primär durch Schäden an der Biodiversität und Fisch Fauna und sekundär durch die Schäden für die Fischerei und anderer Beeinträchtigungen von für den ländlichen Raum relevanten Aktivitäten.
Der Schaden ist mittlerweile so beträchtlich und offensichtlich, so das nun sogar die Fischereiforschung dies in größerem Ausmaß beziffern kann, zum Beispiel Jepsen et al. (2014) und Ovegård (2017). Es ist richtig, dass bei Einführung der Vogelschutz Richtlinie in 1979, sinensis als gefährdet galt, die gesamte Population in West Europa bestand aus ein paar tausend Vögeln in einigen Kolonien.
Das Taxon “5. Phalacrocorax carbo sinensis Cormorant (Kontinentale Rasse)” mit in den Annex 1 “von Wildvögeln die heimisch innerhalb der Mitgliedsstaaten im Europäischen Territorium vorkommen“ aufzunehmen die spezielle Schutzmaßnahmen erfordern kann man durchaus als eine vernünftige Entscheidung ansehen.
Das Problem ist aber, dass es nicht einen einzigen wissenschaftlichen Beweis für die Aussage der Kommission gibt, das sinensis, natürlich, in den EU Mitgliedsstaaten, vorkommt!
Als Ergebnis der Vogelschutzrichtlinie und der EU Erweiterung hat sich die Anzahl der sinensis in weniger als 20 Jahren auf mehrere hundert tausend Vögel erhöht, was dann dazu führte das „die Europäische Kommission entschieden hat den Europäischen Großen Kormoran (Phalacrocorax carbo sinensis) aus Annex I der Wild Vogelschutz Richtlinie (IP/97/718) zu entfernen“.
Dies war eine Entscheidung von geringfügiger Bedeutung und trotz der Möglichkeit von sogenannten Ausnahmeregelungen blieb der Schutz von sinensis so stark, dass keine sinnvollen Aktivitäten im Rahmen der EU Richtlinie möglich waren. Innerhalb des Dokumentes verwendet die Kommission nicht mehr das korrekte Taxon P.c.sinensis sondern vielmehr die allgemeinere Bezeichnung „großer Kormoran“ oder einfach nur „der Kormoran“. Dies ist eine gezielte Desinformation und eine fortgesetzten Verweigerung der Tatsache das es sinensis und nicht carbo ist der sich, als ein direktes Ergebnis der Inkompetenz und der Fehler der Kommission, von einer lediglich fremden Art in 1979 zu einer invasiven Art in 1997 bis hin zu einem richtigen Problem für die Union in 2017 entwickelt hat.
Die Millionen von sinensis die man heute in Europa vorfindet vermehren sich unvermindert und verbreiten sich weiter in neuen, geeigneten Lebensräumen innerhalb der EU und in den benachbarten Ländern. Immer mehr Kolonien entstehen in der Schweiz, Norwegen und den östlichen Ländern und jeden Herbst gibt es in Nord Afrika von Marocco bis nach Agypten und auch in Israel eine Invasion aus Horden von überwinternden sinesis.
Anstelle wissenschaftlicher Analysen zur Ursache des wachsenden Schadens durch sinensis an der Umwelt Europas zu verstehen, finanziert die Kommission Desinformation Projekte um ein wissenschaftliches Problem in einen „Konflikt zwischen Kormoranen, Anglern und der Fischerei“ zu verwandeln. REDCAFE 2003 und INTERCAFE 2004/8-12 und das neueste das 2011 auf der EU Kormoran Plattform erschienene „CorMan“ Projekt (Nachhaltiges Management von Kormoranpopulationen), (englisch “theCORMAN project” Sustainable Management of Cormorant Populations) sind alles Beispiele für die Verleugnung von gravierenden Tatsachen und des mangelhaften Urteilsvermögen der Kommission.
Diese Projekte haben ungebrochenen Erfolg gehabt die sinensis Kern Themen zu vermeiden und andauernd alle berechtigten Einwände abzuweisen. Sie behaupten, dass es nicht möglich wäre irgendwelche größeren Schäden zu beweisen und das die Anzahl abnehmen wird – was ebenfalls einige Medien kritiklos seit 1979 berichten.
Trotz allem darf dieses umweltpolitische Fiasko nicht mehr so weiter gehen und noch schlimmer werden. Zumindest ist jetzt sogar die Kommission aufgewacht und hat den Schaden, der durch nicht heimische Arten an der Europäischen Umwelt verursacht wird, erkannt und hat zumindest formal die Voraussetzungen für umfassende Maßnahmen geschaffen.
Die EU Verordnung 1143/2014 des Europäischen Parlamentes über die Prävention und das Management der Einschleppung und Ausbreitung invasiver gebietsfremder Arten liefert die rechtliche Grundlage für die Verhütung bzw. Verminderung und Verhinderung der negativen Effekte von invasiven gebietsfremden Arten und ermöglicht das gemeinsame bekämpfen bestimmter Arten von denen man weiß das diese eine große Gefahr für die Biodiversität der Europäischen Gemeinschaft darstellen.
Auf der Liste der invasiven gebietsfremden Arten die die Kommission als Grund zur Besorgnis sieht und die sie 2016 veröffentlichte sind schon 3 Vögel aufgeführt. Die Glanzkrähe (Corvus splendens), die Schwarzkopfruderente (Oxyura jamaicensis) und der heilige Afrikanische Ibis (Threskiornis aethiopicus).
Es ist den Naturschutzbehörden der Mitgliedsstaaten vorbehalten weitere Arten vorzuschlagen und es ist sehr wahrscheinlich das die Nilgans (Alopochen aegyptiaca) 2017 auch mit in die Liste aufgenommen wird.
Es ist daher vollkommen selbstverständlich, dass P.C. sinensis ebenfalls eine transparente und unabhängige wissenschaftliche Bewertung auf Basis der gleichen Kriterien durch das Wissenschaftliche Forum zu invasiven gebietsfremden Arten (E03276) erhalten sollte. Der Schaden den sinensis der Natur und der Umwelt in Europa bereits zugefügt hat ist wesentlich größer als der Schaden den die anderen 4 Vögel auf der Liste, zusammen, verursacht haben! Dass die Kommission aber 5die Initiative für so eine Bewertung ergreift ist höchst unwahrscheinlich.
Selbstverständlich haben aber alle EU Bürger das Recht zu verlangen das dieses Thema von den zuständigen Behörden in den jeweiligen Mitgliedsländern untersucht wir. In Schweden ist das die Schwedische Umweltschutzbehörde. Schweden hat eine ganz besondere Verantwortung da in Schweden die größte Zahl nistender Sinensis in ganz Europa und vielleicht sogar in der ganzen Welt vorkommen.
Die Tatsache das der Phalacrocorax carbo sinensis einen gigantischen negativen Einfluss auf die Europäische Biodiversität und die Wirtschaft hat erfüllt ohne jeden Zweifel und in jedem Falle die Kriterien für eine sofortige Aufnahme auf die Liste der invasiven gebietsfremden Arten die die Kommission als Grund zur Besorgnis sieht. Hier ist große Dringlichkeit geboten!
Der Schaden an der Europäischen Umwelt und die Kosten für die betroffenen Industrien werden Tag für Tag in unverminderter Geschwindigkeit weiter ansteigen. Früher oder später müssen die Kosten die aus den Versäumnissen der Kommission entstanden sind bezahlt werden – und diese Rechnung wird natürlich, wie immer, den EU Bürgern präsentiert.
Stavsudda, Schweden, 31 März 2017
Christer Olburs
Übersetzung ins Deutsche am 26.03.2018 Rainer Lemmer













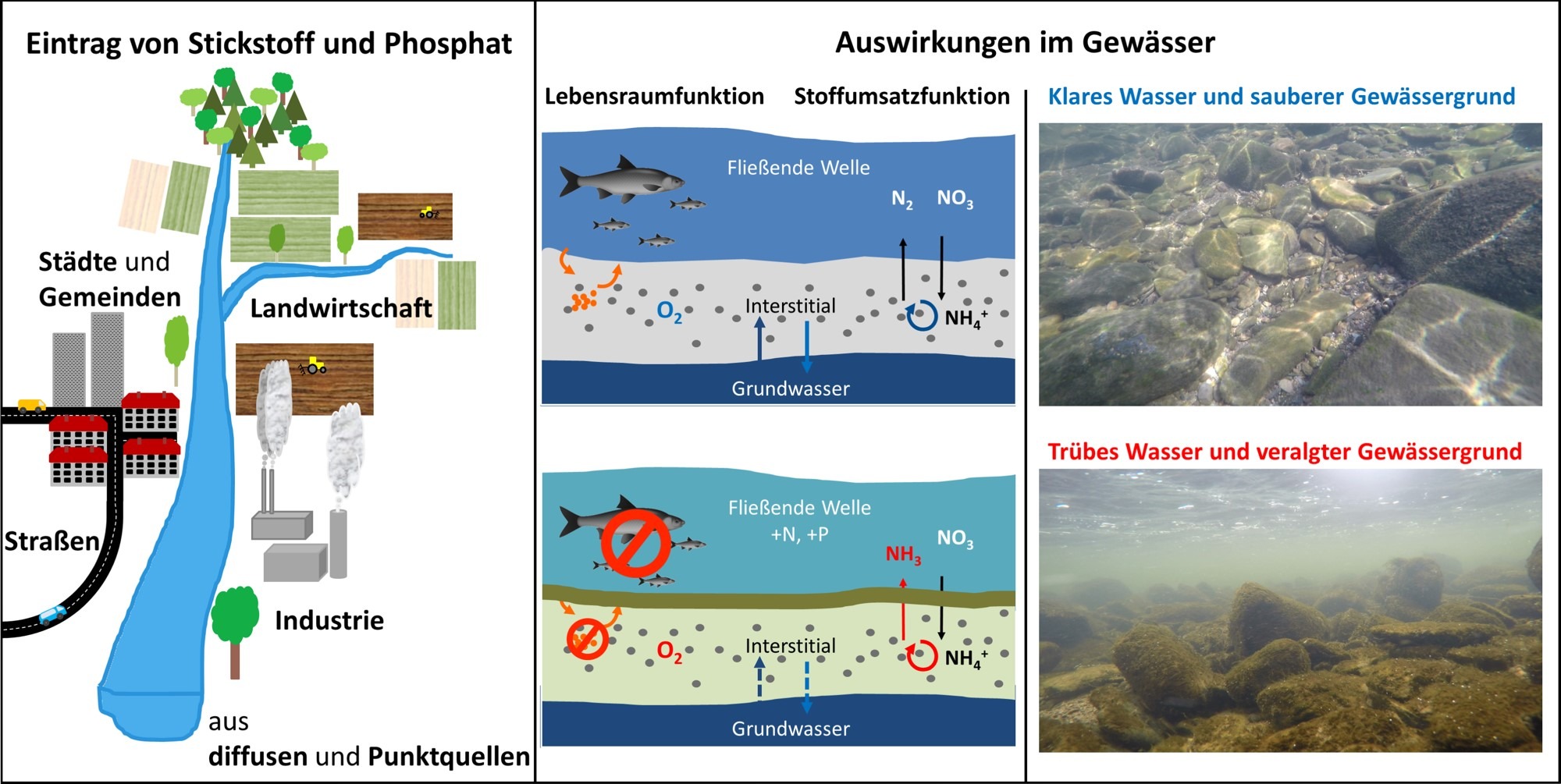





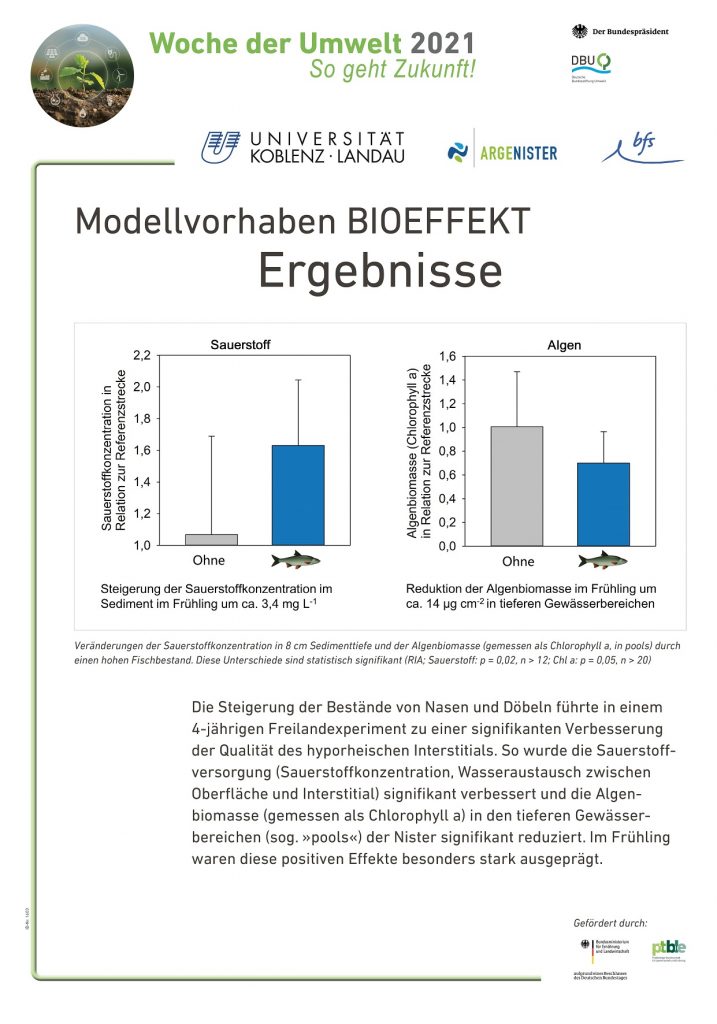


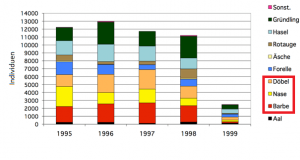







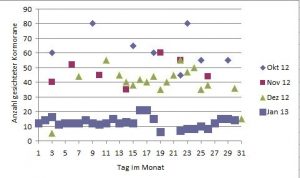
 Zwischenzeitlich wurden Verbrämungsmaßnahmen eingeleitet, die jedoch keinen Erfolg zeigten. Die Vögel realisierten, dass sich mit den Störgeräuschen keine Gefahr verband, und setzten ihr vorheriges Jagdverhalten fort. Seither wird der Bestand innerhalb der gesetzlichen Vorgaben mit einer Sondergenehmigung dezimiert.
Zwischenzeitlich wurden Verbrämungsmaßnahmen eingeleitet, die jedoch keinen Erfolg zeigten. Die Vögel realisierten, dass sich mit den Störgeräuschen keine Gefahr verband, und setzten ihr vorheriges Jagdverhalten fort. Seither wird der Bestand innerhalb der gesetzlichen Vorgaben mit einer Sondergenehmigung dezimiert.